El ozono es un gas azul con un olor distintivo que recuerda al cloro, compuesto por tres átomos de oxígeno. Es altamente reactivo con otros compuestos y se forma de dos maneras principales. De manera natural, resulta de diversas reacciones químicas que ocurren en las capas superiores de la atmósfera, creando una fina capa llamada la capa de ozono en la estratosfera. Esta capa actúa como un escudo protector para nuestro planeta al absorber los dañinos rayos ultravioleta (UV) del sol y evitar que lleguen a la Tierra. El segundo método implica la producción industrial con fines comerciales diversos, aunque se utiliza en concentraciones más bajas debido a su clasificación como contaminante, que puede perjudicar a los humanos, animales y plantas.
El descubrimiento del ozono se remonta al siglo XVIII. En 1785, el químico holandés Martinus van Marum realizó experimentos que involucraban chispas eléctricas sobre agua, observando un olor inusual que atribuyó a las interacciones eléctricas. No reconoció que había producido ozono. No fue sino hasta cincuenta años después que el químico alemán Christian Friedrich Schönbein identificó el mismo olor penetrante como el que a menudo se asocia con los rayos. En 1839, Schönbein logró aislar esta sustancia gaseosa y la denominó «ozono», derivada de la palabra griega «ozein», que significa «oler», debido a su olor distintivo que a veces se detecta después de tormentas. Sin embargo, la fórmula química (O3) no se determinó hasta 1865 por el científico suizo Jacques-Louis Soret.

En la segunda mitad del siglo XIX y en el siglo XX, este gas era considerado un componente beneficioso para el medio ambiente por naturalistas y científicos de la salud, quienes a menudo consideraban que las altitudes elevadas eran ventajosas debido a su contenido de ozono. Sin embargo, a partir de 1873, los científicos James Dewar y John Gray McKendrick comenzaron a observar sus efectos nocivos. Documentaron que las ranas crecían lentamente en su presencia, los pájaros tenían dificultades para respirar y la sangre de los conejos mostraba niveles bajos de oxígeno después de la exposición al aire tratado con ozono. El propio Schönbein reportó problemas de salud debido a la inhalación de ozono. Durante la Primera Guerra Mundial, se probó en Londres como desinfectante potencial para heridas, aplicándolo directamente sobre las heridas durante 15 minutos, resultando en daños a las células bacterianas y a los tejidos humanos. Esto llevó a su abandono y a la búsqueda de técnicas de esterilización alternativas debido a sus efectos nocivos y a su potencial letal a concentraciones elevadas.
Propiedades Físicas y Químicas
El ozono es un gas incoloro o azul pálido, ligeramente soluble en agua y más soluble en disolventes no polares inertes como el tetracloruro de carbono o los clorofluorocarbonos. Se vuelve azul a −112°C, y su forma líquida es peligrosa, ya que tanto el ozono gaseoso concentrado como el líquido pueden explotar a temperaturas superiores a −193,2°C.
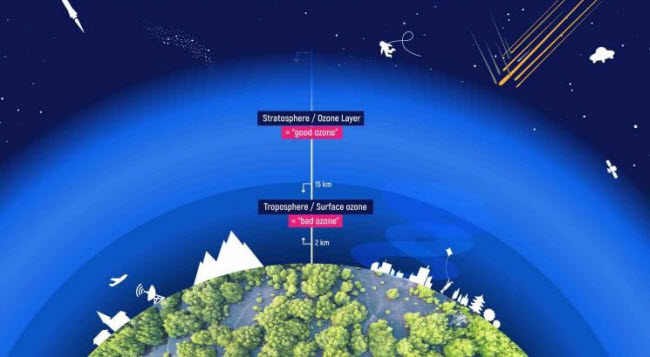
El ozono se forma a partir de la combinación de oxígeno molecular (O2), el oxígeno natural que respiramos, con otra molécula de oxígeno para producir O3. Se encuentra de forma natural en la estratosfera, una capa de la atmósfera que va de 10 a 50 kilómetros sobre la superficie de la Tierra, con una concentración máxima a 32 kilómetros en una región conocida como la capa de ozono. Esta capa protege la Tierra al absorber los rayos UV dañinos del sol, haciendo posible la vida en la Tierra.

Depleción del Ozono
El ozono es relativamente inestable y puede ser destruido por moléculas que contienen nitrógeno, hidrógeno, cloro o bromo. Estas moléculas contribuyen a separar el átomo adicional de oxígeno de la molécula de ozono. Desde la década de 1950, los científicos han estado midiendo las concentraciones de ozono sobre la Antártida, lo que ha dado las primeras pistas sobre los problemas de la capa de ozono. En los años 80, los investigadores pudieron mapear un agujero en esta capa, confirmando más tarde que los contaminantes fabricados por el hombre, conocidos como clorofluorocarbonos (CFC), provenientes de procesos industriales como la refrigeración y la extinción de incendios, eran la causa. Los átomos de cloro y bromo en los CFC son agentes de depleción del ozono, con un solo átomo de cloro capaz de destruir más de 100,000 moléculas de ozono en la estratosfera, según la Agencia de Protección Ambiental de los Estados Unidos (EPA).
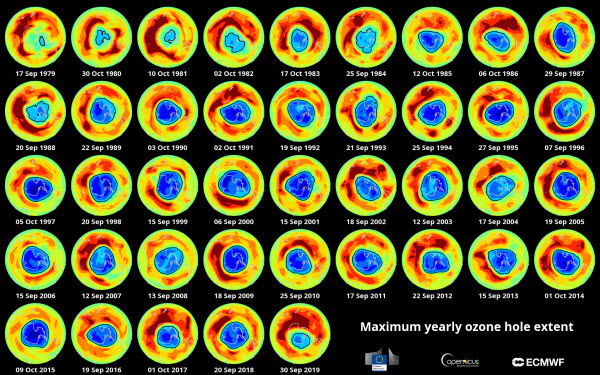
Investigaciones adicionales revelaron que la depleción del ozono no solo ocurría sobre la Antártida, sino también en diversas regiones del mundo. Esto llevó a la firma en 1987 del Protocolo de Montreal sobre sustancias que agotan la capa de ozono, un acuerdo internacional que obliga a los firmantes a eliminar gradualmente los CFC y otros contaminantes dañinos. Estos esfuerzos han dado frutos, como mostró un estudio reciente, con una reducción del 20% en la depleción de ozono debido al cloro entre 2005 y 2016. En 2019, el agujero de ozono sobre la Antártida se redujo a su tamaño más pequeño registrado desde su descubrimiento. Sin embargo, en 2020, los científicos observaron que el agujero de ozono en el Ártico, aunque rara vez abierto, era más grande que el del hemisferio sur, lo que suscitó preocupaciones. Este evento sin precedentes terminó después de dos semanas, y los investigadores aún no saben si este nuevo fenómeno se convertirá en una tendencia regular.
Contaminación del Ozono en la Superficie de la Tierra
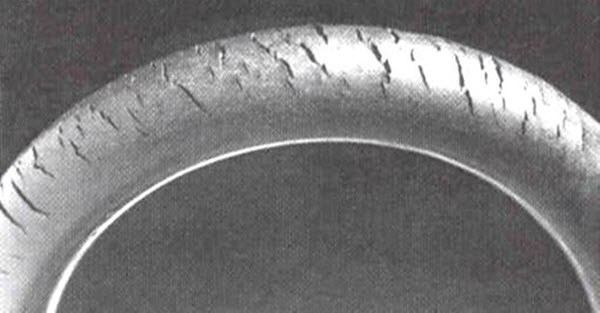
Cerca de la superficie de la Tierra, el ozono puede ser perjudicial y se conoce como smog. Se forma a partir de óxidos de nitrógeno emitidos por vehículos, plantas de energía, calderas industriales, refinerías y fábricas químicas, que reaccionan con otras moléculas orgánicas en la atmósfera. La inhalación de ozono puede causar dolor en el pecho, irritación en la garganta, tos y dañar los tejidos pulmonares. Esto es particularmente peligroso para los niños, los ancianos y aquellos con problemas respiratorios como el asma, el enfisema y la bronquitis. El ozono también afecta a las plantas, impactando los bosques, parques y áreas silvestres, y puede deteriorar el caucho.
Debido a los riesgos del ozono, se clasifica como un contaminante común en la Ley de Aire Limpio de los Estados Unidos. La EPA proporciona una herramienta en línea sobre la calidad del aire para informar a las personas cuando los niveles de contaminación, incluido el ozono, son elevados en su área. Los Centros para el Control y la Prevención de Enfermedades (CDC) recomiendan permanecer en el interior cuando los niveles de ozono son altos, reducir las actividades exteriores intensas y planificar las salidas por la mañana o por la tarde cuando las concentraciones de ozono son más bajas. La EPA ha establecido normas nacionales de calidad del aire para reducir los niveles de ozono en la superficie de la Tierra limitando los contaminantes provenientes de vehículos y fábricas, fomentando caminar, andar en bicicleta y usar transporte público cuando sea posible, y reduciendo el uso de aires acondicionados cuando el ozono esté alto. También recomienda encontrar formas de hacer que las casas sean más ecológicas.
Aplicaciones Industriales del Ozono
El ozono se produce industrialmente utilizando dispositivos llamados generadores de ozono. Se utiliza en diversas industrias, como productos farmacéuticos, lubricantes sintéticos y blanqueadores, así como para matar microorganismos en fuentes de aire y agua. Algunos sistemas de agua potable municipales utilizan ozono para eliminar bacterias en lugar del cloro más común. Las concentraciones bajas de ozono también se usan como desinfectante en hogares, hospitales, fábricas de alimentos y para desinfectar piscinas. Las industrias que dependen del agua, como las cervecerías y las lecherías, utilizan ozono disuelto de manera efectiva como alternativa a desinfectantes químicos como el ácido peracético o a la calor. El ozono también se utiliza para matar insectos en granos almacenados y para otras aplicaciones.