L’ozone est un gaz bleu avec une odeur distinctive ressemblant à celle du chlore, composé de trois atomes d’oxygène. Il est hautement réactif avec d’autres composés et se forme de deux manières principales. Naturellement, il résulte de diverses réactions chimiques se produisant dans les couches supérieures de l’atmosphère, créant une fine couche appelée la couche d’ozone dans la stratosphère. Cette couche agit comme un bouclier protecteur pour notre planète en absorbant les rayons ultraviolets (UV) nocifs du soleil et en empêchant leur arrivée sur Terre. La seconde méthode implique la production industrielle à des fins commerciales diverses, bien qu’il soit utilisé à des concentrations plus faibles en raison de sa classification comme polluant, pouvant nuire aux humains, aux animaux et aux plantes.
La découverte de l’ozone remonte au XVIIIe siècle. En 1785, le chimiste néerlandais Martinus van Marum a réalisé des expériences impliquant des étincelles électriques au-dessus de l’eau, observant une odeur inhabituelle qu’il a attribuée aux interactions électriques. Il n’a pas reconnu qu’il avait produit de l’ozone. Ce n’est que cinquante ans plus tard que le chimiste allemand Christian Friedrich Schönbein a identifié la même odeur pénétrante comme étant celle souvent associée aux éclairs. En 1839, Schönbein a réussi à isoler cette substance gazeuse et l’a nommée « ozone », dérivé du mot grec « ozein », signifiant « sentir », en raison de son odeur distinctive souvent détectable après les orages. Cependant, la formule chimique (O3) n’a été déterminée qu’en 1865 par le scientifique suisse Jacques-Louis Soret.

Dans la seconde moitié du XIXe siècle et au XXe siècle, ce gaz était considéré comme un composant bénéfique pour l’environnement par les naturalistes et les chercheurs en santé, qui considéraient souvent les altitudes élevées comme avantageuses en raison de leur teneur en ozone. Cependant, dès 1873, les scientifiques James Dewar et John Gray McKendrick ont commencé à observer ses effets nocifs. Ils ont documenté que les grenouilles croissaient lentement en sa présence, les oiseaux avaient du mal à respirer et le sang des lapins montrait de faibles niveaux d’oxygène après une exposition à l’air traité à l’ozone. Schönbein lui-même a signalé des problèmes de santé dus à l’inhalation d’ozone. Pendant la Première Guerre mondiale, il a été testé à Londres comme désinfectant potentiel pour les blessures, appliqué directement sur les plaies pendant 15 minutes, entraînant des dommages aux cellules bactériennes et aux tissus humains. Cela a conduit à son abandon et à la recherche de techniques de stérilisation alternatives en raison de ses effets nocifs et de sa potentialité létale à des concentrations élevées.
Propriétés Physiques et Chimiques
L’ozone est un gaz incolore ou bleu pâle, légèrement soluble dans l’eau et plus soluble dans les solvants non polaires inertes tels que le tétrachlorure de carbone ou les chlorofluorocarbones. Il devient bleu à −112°C, et sa forme liquide est dangereuse, car l’ozone gazeux concentré et liquide peuvent exploser à des températures supérieures à −193,2°C.
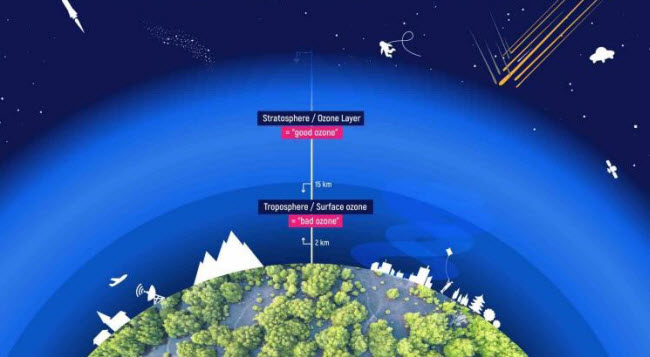
L’ozone se forme de la combinaison de l’oxygène moléculaire (O2), l’oxygène naturel que nous respirons, avec une autre molécule d’oxygène pour produire O3. Il se trouve naturellement dans la stratosphère, une couche de l’atmosphère allant de 10 à 50 kilomètres au-dessus de la surface de la Terre, avec une concentration maximale à 32 kilomètres dans une région connue sous le nom de couche d’ozone. Cette couche protège la Terre en absorbant les rayons UV nocifs du soleil, rendant la vie sur Terre possible.

Déplétion de l’Ozone
L’ozone est relativement instable et peut être détruit par des molécules contenant de l’azote, de l’hydrogène, du chlore ou du brome. Ces molécules contribuent à séparer l’atome d’oxygène supplémentaire de la molécule d’ozone. Depuis les années 1950, les scientifiques mesurent les concentrations d’ozone au-dessus de l’Antarctique, ce qui a donné les premiers indices sur les problèmes de la couche d’ozone. Dans les années 1980, les chercheurs ont cartographié un trou dans cette couche, confirmant plus tard que les polluants fabriqués par l’homme, appelés chlorofluorocarbones (CFC), provenant des processus industriels tels que la réfrigération et l’extinction des incendies, en étaient la cause. Les atomes de chlore et de brome dans les CFC sont des agents de déplétion de l’ozone, un seul atome de chlore pouvant détruire plus de 100 000 molécules d’ozone dans la stratosphère, selon l’Agence de protection de l’environnement des États-Unis (EPA).
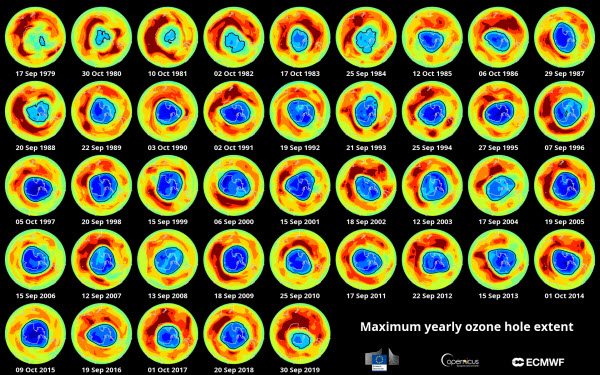
Des recherches supplémentaires ont révélé que la déplétion de l’ozone ne se produisait pas seulement au-dessus de l’Antarctique, mais aussi dans diverses régions du monde. Cela a conduit à la signature en 1987 du Protocole de Montréal sur les substances qui appauvrissent la couche d’ozone, un accord international engageant les signataires à éliminer progressivement les CFC et autres polluants nuisibles. Ces efforts ont porté leurs fruits, comme l’a montré une étude récente, avec une réduction de 20 % de la déplétion de l’ozone due au chlore entre 2005 et 2016. En 2019, le trou de l’ozone au-dessus de l’Antarctique avait diminué à sa plus petite taille enregistrée depuis sa découverte. Cependant, en 2020, les scientifiques ont observé que le trou de l’ozone arctique, bien qu’il soit rarement ouvert, était plus grand que celui de l’Antarctique, suscitant des inquiétudes. Cet événement sans précédent a pris fin après deux semaines, et les chercheurs ignorent encore si ce phénomène nouveau deviendra une tendance régulière.
Pollution de l’Ozone à la Surface de la Terre
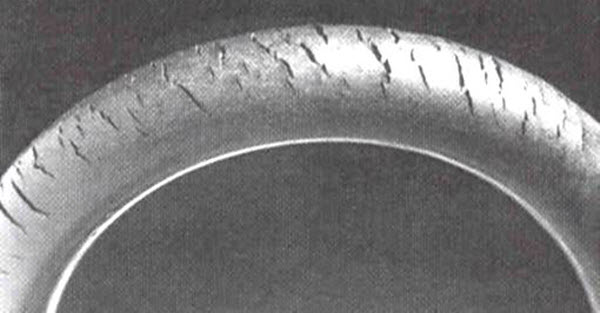
Près de la surface de la Terre, l’ozone peut être nocif et est connu sous le nom de smog. Il se forme à partir des oxydes d’azote émis par les véhicules, les centrales électriques, les chaudières industrielles, les raffineries et les usines chimiques, réagissant avec d’autres molécules organiques dans l’atmosphère. L’inhalation d’ozone peut provoquer des douleurs thoraciques, des irritations de la gorge, de la toux et endommager les tissus pulmonaires. Cela est particulièrement dangereux pour les enfants, les personnes âgées et celles ayant des problèmes respiratoires tels que l’asthme, l’emphysème et la bronchite. L’ozone affecte également les plantes, impactant les forêts, les parcs et les zones sauvages, et peut dégrader le caoutchouc.
En raison des risques de l’ozone, il est répertorié comme un polluant courant dans la loi américaine sur l’air pur. L’EPA fournit un outil en ligne sur la qualité de l’air pour informer les gens lorsque les niveaux de pollution, y compris l’ozone, sont élevés dans leur région. Les Centers for Disease Control and Prevention (CDC) recommandent de rester à l’intérieur lorsque les niveaux d’ozone sont élevés, de réduire les activités extérieures intenses et de planifier les sorties le matin ou le soir lorsque les concentrations d’ozone sont plus faibles. L’EPA a établi des normes nationales de qualité de l’air visant à réduire les niveaux d’ozone à la surface de la Terre en limitant les polluants provenant des véhicules et des usines, en encourageant la marche, le vélo et les transports en commun lorsque cela est possible, et en réduisant l’utilisation des climatiseurs lorsque l’ozone est élevé. Elle recommande également de trouver des moyens de rendre les maisons plus écologiques.
Applications Industrielles de l’Ozone
L’ozone est produit industriellement à l’aide d’appareils appelés générateurs d’ozone. Il est utilisé dans diverses industries, notamment les produits pharmaceutiques, les lubrifiants synthétiques et les agents de blanchiment, ainsi que pour tuer les micro-organismes dans les sources d’air et d’eau. Certains systèmes d’eau potable municipaux utilisent l’ozone pour tuer les bactéries au lieu du chlore plus courant. De faibles concentrations d’ozone sont également utilisées comme désinfectant dans les maisons, les hôpitaux, les usines alimentaires et la désinfection des piscines. Les industries dépendantes de l’eau, telles que les brasseries et les laiteries, utilisent l’ozone dissous de manière efficace comme alternative aux désinfectants chimiques tels que l’acide peracétique ou à la chaleur. L’ozone est également utilisé pour tuer les insectes dans les céréales stockées et pour d’autres applications.